Теория:
Атом — это электронейтральная частица, состоящая из положительно заряженного ядра и электронной оболочки.
В состав ядра входят нуклоны, или ядерные частицы. Это протоны и нейтроны. Электронная оболочка образована электронами. Протоны, нейтроны и электроны называют элементарными частицами атома.
Нуклоны в ядре удерживаются ядерным взаимодействием, энергия которого намного больше энергии химической связи. Поэтому в химических реакциях ядра не разрушаются.
Протон (\(p\)) — это частица с относительным зарядом \(+1\) и относительной массой \(1\).
Нейтрон (\(n\)) не имеет заряда, а его относительная масса тоже равна \(1\).
Электрон () имеет заряд \(-1\), а его масса в \(1837\) раз меньше массы протона и нейтрона.
Строение атома можно охарактеризовать по положению химического элемента в периодической системе.
Порядковый номер элемента равен заряду ядра, числу протонов в ядре и числу электронов в его электронной оболочке.
Учитывая, что масса атома в основном сосредоточена в ядре и масса каждого нуклона равна \(1\), можно определить число нейтронов. Для этого от массового числа нужно отнять число протонов (порядковый номер).
Пример:
порядковый номер радия \(88\), относительная атомная масса равна \(226\). Значит, в атоме содержится \(88\) протонов и \(88\) электронов, а число нейтронов равно \(226 - 88 = 138\).
Изотопы
Число нейтронов в атомах одного элемента непостоянно. Поэтому атомы одного химического элемента могут различаться своими массами и существуют в виде разных нуклидов (изотопов).
Изотопы (нуклиды) — разновидности атомов с одинаковым зарядом ядра, но разными массами.
Изотопы с одинаковым зарядом ядра составляют химический элемент. Их обозначают, указывая справа вверху от символа элемента массовое число. Справа внизу часто записывают также протонное число (порядковый номер): , .
Большинство химических элементов в природе представлено несколькими разновидностями атомов. Всего их известно более \(2500\).
Пример:
водород в природе представлен тремя изотопами. Ядро самого лёгкого изотопа (протия) состоит только из одного протона. В ядре дейтерия один протон и один нейтрон, а в ядре трития один протон и два нейтрона.
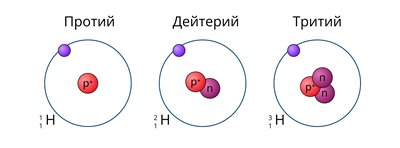
Рис. \(1\). Изотопы водорода
Указанная в периодической системе относительная атомная масса — это средняя масса всех существующих в природе изотопов данного элемента. Когда мы её округляем до целых, то получаем массу самого распространённого изотопа.
Источники:
Рис. 1. Изотопы водорода. © ЯКласс